· Mikroskop Cahaya (Brightfield Microscope)
Salah satu alat untuk melihat sel mikroorganisme adalah mikroskop cahaya. Dengan mikroskop kita dapat mengamati sel bakteri yang tidak dapat dilihat dengan mata telanjang. Pada umumnya mata tidak mampu membedakan benda dengan diameter lebih kecil dari 0,1 mm. berikut merupakan uraian tentang cara penggunaan bagian-bagiandan spesifikasi mikroskop cahaya merk Olympus CH20 yang dimiliki Laboratorium Mikrobiologi.
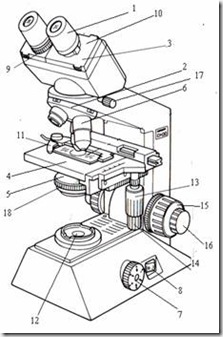
Bagian-bagian Mikroskop:
- Eyepiece / oculars (lensa okuler)
Untuk memperbesar bayangan yang dibentuk lensa objektif
- Revolving nosepiece (pemutar lensa objektif)
Untuk memutar objektif sehingga mengubah perbesaran
- Observation tube (tabung pengamatan / tabung okuler)
- Stage (meja benda)
Spesimen diletakkan di sini
- Condenser (condenser)
Untuk mengumpulkan cahaya supaya tertuju ke lensa objektif
- Objective lense (lensa objektif)
Memperbesar spesimen
- Brightness adjustment knob (pengatur kekuatan lampu)
Untuk memperbesar dan memperkecil cahaya lampu
- Main switch (tombol on-off)
- Diopter adjustmet ring (cincin pengatur diopter)
Untuk menyamakan focus antara mata kanan dan kiri
- Interpupillar distance adjustment knob (pengatur jarak interpupillar)
- Specimen holder (penjepit spesimen)
- Illuminator (sumber cahaya)
- Vertical feed knob (sekrup pengatur vertikal)
Untuk menaikkan atau menurunkan object glass
- Horizontal feed knob (sekrup pengatur horizontal)
Untuk menggeser ke kanan / kiri objek glas
- Coarse focus knob (sekrup fokus kasar)
Menaik turunkan meja benda (untuk mencari fokus) secara kasar dan cepat
- Fine focus knob (sekrup fokus halus)
Menaik turunkan meja benda secara halus dan lambat
- Observation tube securing knob (sekrup pengencang tabung okuler)
- Condenser adjustment knob (sekrup pengatur kondenser)
Untuk menaik-turunkan kondenser
Prosedur Operasi
1. Menyalakan lampu
a. tekan tombol on (8)
b. atur kekuatan lampu dengan memutar bagian (7)
2. Menempatkan spesimen pada meja benda
a. Letakan objek glas diatas meja benda (4) kemudian jepit dengan (11). Jika meja benda belum turun, diturunkan dengan sekrup kasar (15)
b.Cari bagian dari objek glas yang terdapat preparat ulas (dicari dan diperkirakan memiliki gambar yang jelas) dengan memutar sekrup vertikal dan horizontal (13) dan (14)
3. Memfokuskan
a.  Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus
Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus
 Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus
Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokusb.Setelah fokus perbesaran 4 x 10 didapatkan, maka putar (2) pada perbesaran selanjutnya yaitu perbesaran objektif 10x. kemudian putar sekrup halus (16) untuk mendapatkan fokusnya
c. Lakukan hal yang sama jika menggunakan perbesaran yang lebih tinggi
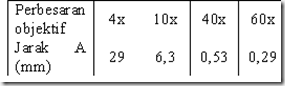
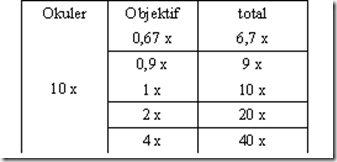
Berikut adalah tabel yang menunjukan jarak antara spesimen dengan lensa objektif jika okus telah didapatkan
Catatan: Setelah mendapatkkan fokus pada perbesaran tetentu, misal 40x, dan ingin memutar objektif ke perbesaran 100x, maka meja benda tidak perlu diturunkan dan tidak perlu khawatir bahwa lensa objektif akan menggesek cover glass karena terdapat sisa jarak A yang lebih kecil antara cover glass dengan lensa objektif (lihat tabel diatas).
4. Tambahan
a. Jika perlu interpupillar distance adjustment knob (10) dapat digeser, hal ini akan mengubah dua bayangan yang akan diterima oleh 2 mata menjadi gambar yang tunggal sehingga sangat membantu dalam mengatasi kelelahan mata
b. Jika perlu diopter adjustment knob (9) dapat diatur untuk memperoleh bayangan focus yang seimbang antara mata kanan dan kiri
c. Pengaturan condenser (5) akan memperjelas bayangan yang tampak dengan mensetting pada posisi tertinggi (cahaya penuh)
Perbesaran total
Ukuran specimen yang diamati dapat diperoleh dengan mengalikan perbesaran lensa okuler dengan lensa objektif. Misal = Okuler (10x) x Objektif (40x) = 400x
Penggunaan minyak imersi
Semakin kecil nilai daya pisah, akan semakin kuat kemampuan lensa untuk memisahkan dua titikyang berdekatan pada preparat sehingga struktur benda terlihat lebih jelas. Daya pisah dapat diperkuat dengan memperbesarkan indeks bias atau menggunakan cahaya yang memiliki panjang gelombang (λ) pendek. Biasanya dapat digunakan minyak imersi untuk meningkatkan indeks bias pada perbesaran 10 x 100
a. Jika fokus pada perbesaran 10 x 40 telah didapatkan maka putar ke perbesaran objektif 100x
b. tetesi minyak imersi 1 – 2 tetes dari sisi lensa
c. Jika telah selesai menggunakan mikroskop, bersihkan lensa objektif 100x dengan kertas lensa yang dibasahi xylol
· Mikroskop stereo (Zoom Stereo Microscope)
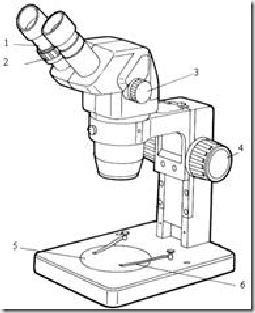 Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya digunakan untuk mengamati secara detail bentuk koloni dan jamur. Berikut merupakan uraian tentang mikroskop stereo yang dimiliki Laboratorium Mikrobiologi yaitu Zoom Stereo Microscope, Olimpus SZ3060.
Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya digunakan untuk mengamati secara detail bentuk koloni dan jamur. Berikut merupakan uraian tentang mikroskop stereo yang dimiliki Laboratorium Mikrobiologi yaitu Zoom Stereo Microscope, Olimpus SZ3060.1. Oculars eyepiece (lensa okuler)
2. Diopter adjustment ring (cincin pengatur diopter)
3. Zoom control knob (sekrup pengatur pembesaran)
4. Focusing knob (sekrup pengatur fokus)
5. Stage plate (pelat tempat specimen diletakkan)
6. Stage clip (penjepit spesimen / preparat)
Prosedur operasi
- Letakkan spesimen / preparat di stage plate (5), jepit jika perlu
- Atur perbesaran pada perbesaran terkecil dengan memutar Zoom Control Knob (3) kemudian dicari fokusnya dengan memutar Focusing Knob (4)
Mikroskop ini memiliki pilihan perbesaran:
Autoklaf (Autoclave)
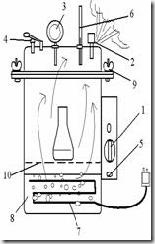
Diagram autoklaf vertical
1. Tombol pengatur waktu mundur (timer)
2. Katup pengeluaran uap
3. pengukur tekanan
4. kelep pengaman
5. Tombol on-off
6. Termometer
7. Lempeng sumber panas
8. Aquades (dH2O)
9. Sekrup pengaman
10. batas penambahan air
Autoclave adalah alat untuk mensterilkan berbagai macam alat dan bahan yang digunakan dalam mikrobiologi menggunakan uap air panas bertekanan. Tekanan yang digunakan pada umumnya 15 Psi atau sekitar 2 atm dan dengan suhu 121oC (250oF). Jadi tekanan yang bekerja ke seluruh permukaan benda adalah 15 pon tiap inchi2 (15 Psi = 15 pounds per square inch). Lama sterilisasi yang dilakukan biasanya 15 menit untuk 121oC.
Cara Penggunaan :
1. Sebelum melakukan sterilisasi cek dahulu banyaknya air dalam autoklaf. Jika air kurang dari batas yang ditentukan, maka dapat ditambah air sampai batas tersebut. Gunakan air hasil destilasi, untuk menghindari terbentuknya kerak dan karat.
2. Masukkan peralatan dan bahan. Jika mensterilisasi botol beretutup ulir, maka tutup harus dikendorkan.
3. Tutup autoklaf dengan rapat lalu kencangkan baut pengaman agar tidak ada uap yang keluar dari bibir autoklaf. Klep pengaman jangan dikencangkan terlebih dahulu.
4. Nyalakan autoklaf, diatur timer dengan waktu minimal 15 menit pada suhu 121oC.
5. Tunggu samapai air mendidih sehingga uapnya memenuhi kompartemen autoklaf dan terdesak keluar dari klep pengaman. Kemudian klep pengaman ditutup (dikencangkan) dan tunggu sampai selesai. Penghitungan waktu 15’ dimulai sejak tekanan mencapai 2 atm.
6. Jika alarm tanda selesai berbunyi, maka tunggu tekanan dalam kompartemen turun hingga sama dengan tekanan udara di lingkungan (jarum pada preisure gauge menunjuk ke angka nol). Kemudian klep-klep pengaman dibuka dan keluarkan isi autoklaf dengan hati-hati.
· Inkubator (Incubator)
Inkubator adalah alat untuk menginkubasi atau memeram mikroba pada suhu yang terkontrol. Alat ini dilengkapi dengan pengatur suhu dan pengatur waktu. Kisaran suhu untuk inkubator produksi Heraeus B5042 misalnya adalah 10-70oC..
· Hot plate stirrer dan Stirrer bar
 Hot plate stirrer dan Stirrer bar (magnetic stirrer) berfungsi untuk menghomogenkan suatu larutan dengan pengadukan. Pelat (plate) yang terdapat dalam alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. Pengadukan dengan bantuan batang magnet Hot plate dan magnetic stirrer seri SBS-100 dari SBS® misalnya mampu menghomogenkan sampai 10 L, dengan kecepatan sangat lambat sampai 1600 rpm dan dapat dipanaskan sampai 425oC.
Hot plate stirrer dan Stirrer bar (magnetic stirrer) berfungsi untuk menghomogenkan suatu larutan dengan pengadukan. Pelat (plate) yang terdapat dalam alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. Pengadukan dengan bantuan batang magnet Hot plate dan magnetic stirrer seri SBS-100 dari SBS® misalnya mampu menghomogenkan sampai 10 L, dengan kecepatan sangat lambat sampai 1600 rpm dan dapat dipanaskan sampai 425oC.Alat ini berguna untuk mempermudah perhitungan koloni yang tumbuh setelah diinkubasi di dalam cawankarena adanya kaca pembesar. Selain itu alat tersebut dilengkapi dengan skala/ kuadran yang sangat berguna untuk pengamatan pertumbuhan koloni sangat banyak. Jumlah koloni pada cawan Petri dapat ditandai dan dihitung otomatis yang dapat di-reset.
· Biological Safety Cabinet
Biological Safety Cabinet (BSC) atau dapat juga disebut Laminar Air Flow (LAF) adalah alat yang berguna untuk bekerja secara aseptis karena BSC mempunyai pola pengaturan dan penyaring aliran udara sehingga menjadi steril dan aplikasisinar UV beberapa jam sebelum digunakan. Prosedur penggunaan BSC seri 36212, Purifier™ Biological Safety Cabinet dari LABCONCO yang dimiliki labor atorium mikrobiologi adalah sebagai berikut:
atorium mikrobiologi adalah sebagai berikut:
 atorium mikrobiologi adalah sebagai berikut:
atorium mikrobiologi adalah sebagai berikut:1. Hidupkan lampu UV selama 2 jam, selanjutnya matikan segera sebelum mulai bekerja
2. Pastikan kaca penutup terkunci dan pada posisi terendah
3. Nyalakan lampu neon dan blower
4. Biarkan selama 5 menit
5. Cuci tangan dan lengan dengan sabun gemisidal / alkohol 70 %
6. Usap permukaan interior BSC dengan alkohol 70 % atau desinfektan yang cocok dan biarkan menguap
7. masukkan alat dan bahan yang akan dikerjakan, jangan terlalu penuh (overload) karena memperbesar resiko kontaminan
8. Atur alat dan bahan yang telah dimasukan ke BSC sedemikian rupa sehingga efektif dalam bekerja dan tercipta areal yang benar-benar steril
9. Jangan menggunakan pembakar Bunsen dengan bahan bakar alkohol tapi gunakan yang berbahan bakar gas.
10. Kerja secara aseptis dan jangan sampai pola aliran udara terganggu oleh aktivitas kerja
11. setelah selesai bekerja, biarkan 2-3 menit supaya kontaminan tidak keluar dari BSC
12. Usap permukaan interior BSC dengan alkohol 70 % dan biarkan menguap lalu tangan dibasuh dengan desinfektan
13. Matikan lampu neon dan blower
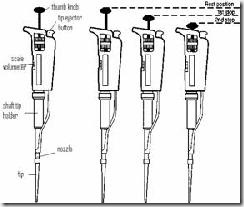
· Mikropipet (Micropippete) dan Tip
Mikropipet adalah alat untuk memindahkan cairan yang bervolume cukup kecil, biasanya kurang dari 1000 µl. Banyak pilihan kapasitas dalam mikropipet, misalnya mikropipet yang dapat diatur volume pengambilannya (adjustable volume pipette) antara 1µl sampai 20 µl, atau mikropipet yang tidak bisa diatur volumenya, hanya tersedia satu pilihan volume (fixed volume pipette) misalnya mikropipet 5 µl. dalam penggunaannya, mukropipet memerlukan tip.
Cara Penggunaan :
1. Sebelum digunakan Thumb Knob sebaiknya ditekan berkali-kali untuk memastikan lancarnya mikropipet.
2. Masukkan Tip bersih ke dalam Nozzle / ujung mikropipet.
3. Tekan Thumb Knob sampai hambatan pertama / first stop, jangan ditekan lebih ke dalam lagi.
4. Masukkan tip ke dalam cairan sedalam 3-4 mm.
5. Tahan pipet dalam posisi vertikal kemudian lepaskan tekanan dari Thumb Knob maka cairan akan masuk ke tip.
6. Pindahkan ujung tip ke tempat penampung yang diinginkan.
7. Tekan Thumb Knob sampai hambatan kedua / second stop atau tekan semaksimal mungkin maka semua cairan akan keluar dari ujung tip.
8. Jika ingin melepas tip putar Thumb Knob searah jarum jam dan ditekan maka tip akan terdorong keluar dengan sendirinya, atau menggunakan alat tambahan yang berfungsi mendorong tip keluar.
· Cawan Petri (Petri Dish)
Cawan petri berfungsi untuk membiakkan (kultivasi) mikroorganisme. Medium dapat dituang ke cawan bagian bawah dan cawan bagian atas sebagai penutup. Cawan petri tersedia dalam berbagai macam ukuran, diameter cawan yang biasa berdiameter 15 cm dapat menampung media sebanyak 15-20 ml, sedangkan cawan berdiameter 9 cm kira-kira cukup diisi media sebanyak 10 ml.
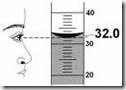
· Pipet Ukur (Measuring Pippete)
 Pipet ukur merupakan alat untuk memindahkan larutan dengan volume yang diketahui. Tersedia berbagai macam ukuran kapasitas pipet ukur, diantaranya pipet berukuran 1 ml, 5 ml dan 10 ml. Cara penggunaanya adalah cairan disedot dengan pipet ukur dengan bantuan filler sampai dengan volume yang diingini. Volume yang dipindahkan dikeluarkan menikuti skala yang tersedia (dilihat bahwa skala harus tepat sejajar dengan mensikus cekung cairan) dengan cara menyamakan tekanan filler dengan udara sekitar.
Pipet ukur merupakan alat untuk memindahkan larutan dengan volume yang diketahui. Tersedia berbagai macam ukuran kapasitas pipet ukur, diantaranya pipet berukuran 1 ml, 5 ml dan 10 ml. Cara penggunaanya adalah cairan disedot dengan pipet ukur dengan bantuan filler sampai dengan volume yang diingini. Volume yang dipindahkan dikeluarkan menikuti skala yang tersedia (dilihat bahwa skala harus tepat sejajar dengan mensikus cekung cairan) dengan cara menyamakan tekanan filler dengan udara sekitar. · Pipet tetes (Pasteur Pippete)
Fungsinya sama dengan pipet ukur, namun volume yang dipindahkan tidak diketahui. Salah satu penerapannya adalah dalam menambahkan HCl / NaOH saat mengatur pH media, penambahan reagen ada uji biokimia, dll.
· Tabung reaksi (Reaction Tube / Test Tube)

· Labu Erlenmeyer (Erlenmeyer Flask)
Berfungsi untuk menampung larutan, bahan atau cairan yang. Labu Erlenmeyer dapat digunakan untuk meracik dan menghomogenkan bahan-bahan komposisi media, menampung akuades, kultivasi mikroba dalam kultur cair, dll. Terdapat beberapa pilihan berdasarkan volume cairan yang dapat ditampungnya yaitu 25 ml, 50 ml, 100 ml, 250 ml, 300 ml, 500 ml, 1000 ml, dsb.
· Gelas ukur (Graduated Cylinder)
Berguna untuk mengukur volume suatu cairan, seperti labu erlenmeyer, gelas ukur memiliki beberapa pilihan berdasarkan skala volumenya. Pada saat mengukur volume larutan, sebaiknya volume tersebut ditentukan berdasarkan meniskus cekung larutan.
· Batang L (L Rod)
 Batang L bermanfaat untuk menyebarkan cairan di permukaan agar supaya bakteri yang tersuspensi dalam cairan tersebut tersebar merata. Alat ini juga disebut spreader.
Batang L bermanfaat untuk menyebarkan cairan di permukaan agar supaya bakteri yang tersuspensi dalam cairan tersebut tersebar merata. Alat ini juga disebut spreader.· Mortar dan Pestle
Mortar dan penumbuk (pastle) digunakan untuk menumbuk atau menghancurkan materi cuplikan, misal daging, roti atau tanah sebelum diproses lebih lanjut.
· Beaker Glass
Beaker glass merupakan alat yang memiliki banyak fungsi. Di dalam mikrobiologi, dapat digunakan untuk preparasi media media, menampung akuades dll..
Salah satu alat yang berfungsi untuk menciptakan kondisi yang steril adalah pembakar bunsen. Untuk sterilisasi jarum ose atau yang lain, bagian api yang paling cocok untuk memijarkannya adalah bagian api yang berwarna biru (paling panas). Perubahan bunsen dapat menggunakan bahan bakar gas atau metanol.
· Glass Beads
Glass Beads adalah manik-manik gelas kecil yang digunakan untuk meratakan suspensi biakan dengan menyebarkan beberapa butir di atas permukaan agar dan digoyang merata. Glass beads digunakan pada teknik spread plate yang fungsinya sama dengan batang L atau Spreader.
· Tabung Durham
Tabung durham berbentuk mirip dengan tabung reaksi namun ukurannya lebih kecil dan berfungsi untuk menampung/menjebak gas yang terbentuk akibat metabolisme pada bakteri yang diujikan. Penempatannya terbalik dalam tabung reaksi dan harus terendam sempurna dalam media (jangan sampai ada sisa udara).
· Jarum Inokulum
 Jarum inokulum berfungsi untuk memindahkan biakan untuk ditanam/ditumbuhkan ke media baru. Jarum inokulum biasanya terbuat dari kawat nichrome atau platinum sehingga dapat berpijar jika terkena panas. Bentuk ujung jarum dapat berbentuk lingkaran (loop) dan disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut inoculating needle/Transfer needle. Inoculating loop cocok untuk melakukan streak di permukaan agar, sedangkan inoculating needle cocok digunakan untuk inokulasi secara tusukan pada agar tegak (stab inoculating). Jarum inokulum ini akan sangat bermanfaat saat membelah agar untuk preprasi Heinrich’s Slide Culture.
Jarum inokulum berfungsi untuk memindahkan biakan untuk ditanam/ditumbuhkan ke media baru. Jarum inokulum biasanya terbuat dari kawat nichrome atau platinum sehingga dapat berpijar jika terkena panas. Bentuk ujung jarum dapat berbentuk lingkaran (loop) dan disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut inoculating needle/Transfer needle. Inoculating loop cocok untuk melakukan streak di permukaan agar, sedangkan inoculating needle cocok digunakan untuk inokulasi secara tusukan pada agar tegak (stab inoculating). Jarum inokulum ini akan sangat bermanfaat saat membelah agar untuk preprasi Heinrich’s Slide Culture.Pinset memiliki banyak fungsi diantaranya adalah untuk mengambil benda dengan menjepit misalnya saat memindahkan cakram antibiotik.
· pH Indikator Universal
berguna untuk mengukur/mengetahui pH suatu larutan. Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
 Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.· Pipet Filler / Rubber Bulb
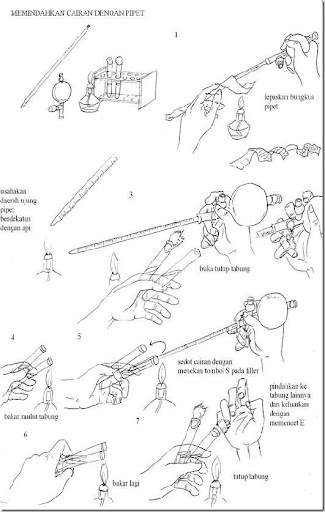
 Filler adalah alat untuk menyedot larutan yang dapat dipasang pada pangkal pipet ukur. Karet sebagai bahan filler merupakan karet yang resisten bahan kimia. Filler memiliki 3 saluran yang masing-masing saluran memiliki katup. Katup yang bersimbol A (aspirate) berguna untuk mengeluarkan udara dari gelembung. S (suction) merupakan katup yang jika ditekan maka cairan dari ujung pipet akan tersedot ke atas. Kemudian katup E (exhaust) berfungsi untuk mengeluarkan cairan dari pipet ukur.
Filler adalah alat untuk menyedot larutan yang dapat dipasang pada pangkal pipet ukur. Karet sebagai bahan filler merupakan karet yang resisten bahan kimia. Filler memiliki 3 saluran yang masing-masing saluran memiliki katup. Katup yang bersimbol A (aspirate) berguna untuk mengeluarkan udara dari gelembung. S (suction) merupakan katup yang jika ditekan maka cairan dari ujung pipet akan tersedot ke atas. Kemudian katup E (exhaust) berfungsi untuk mengeluarkan cairan dari pipet ukur.BAB 2 MEDIA PERTUMBUHAN
Membuat media pertumbuhan Nutrient Agar dan Potato Dextrose Agar
Media pertumbuhan :
a. Pengertian dan fungsi
b. Bahan-bahan media pertumbuhan
b.1 Bahan dasar
b.2 Nutrisi atau zat makanan
b.3 Bahan tambahan
b.4 Bahan yang sering digunakan dalam pembuatan media
c. Macam-macam media pertumbuhan
c.1 Berdasarkan sifat fisik
c.2 Berdasarkan komposisi
c.3 Berdasarkan tujuan
d. Pembuatan Nutrient Agar dan Nutrient Broth
e. Pembuatan Potato Dextrose Agar
Pengertian dan Fungsi
Media pertumbuhan mikroorganisme adalah suatu bahan yang terdiri dari campuran zat-zat makanan (nutrisi) yang diperlukan mikroorganisme untuk pertumbuhannya. Mikroorganisme memanfaatkan nutrisi media berupa molekul-molekul kecil yang dirakit untuk menyusun komponen sel. Dengan media pertumbuhan dapat dilakukan isolat mikroorganisme menjadi kultur murni dan juga memanipulasi komposisi media pertumbuhannya.
Bahan-bahan media pertumbuhan
1. Bahan dasar
Ø air (H2O) sebagai pelarut
Ø agar (dari rumput laut) yang berfungsi untuk pemadat media. Agar sulit didegradasi oleh mikroorganisme pada umumnya dan mencair pada suhu 45 oC.
Ø gelatin juga memiliki fungsi yang sama seperti agar. Gelatin adalah polimer asam amino yang diproduksi dari kolagen. Kekurangannnya adalah lebih banyak jenis mikroba yang mampu menguraikannya dibanding agar.
Ø Silica gel, yaitu bahan yang mengandung natrium silikat. Fungsinya juga sebagai pemadat media. Silica gel khusus digunakan untuk memadatkan media bagi mikroorganisme autotrof obligat.
2. Nutrisi atau zat makanan
Media harus mengandung unsur-unsur yang diperlukan untuk metabolisme sel yaitu berupa unsur makro seperti C, H, O, N, P; unsur mikro seperti Fe, Mg dan unsur pelikan/trace element.
Ø Sumber karbon dan energi yang dapat diperoleh berupa senyawa organik atau anorganik esuai dengan sifat mikrobanya. Jasad heterotrof memerlukan sumber karbon organik antara lain dari karbohidrat, lemak, protein dan asam organik.
Ø Sumber nitrogen mencakup asam amino, protein atau senyawa bernitrogen lain. Sejumlah mikroba dapat menggunakan sumber N anorganik seperti urea.
Ø Vitamin-vitamin.
3. Bahan tambahan
Bahan-bahan tambahan yaitu bahan yang ditambahkan ke medium dengan tujuan tertentu, misalnya phenol red (indikator asam basa) ditambahkan untuk indikator perubahan pH akibat produksi asam organik hasil metabolisme. Antibiotik ditambahkan untuk menghambat pertumbuhan mikroba non-target/kontaminan.
4. Bahan yang sering digunakan dalam pembuatan media
Ø Agar, agar dapat diperoleh dalam bentuk batangan, granula atau bubuk dan terbuat dari beberapa jenis rumput laut. Kegunaannya adalah sebagai pemadat (gelling) yang pertama kali digunakan oleh Fraw & Walther Hesse untuk membuat media. Jika dicampur dengan air dingin, agar tidak akan larut. Untuk melarutkannya harus diasuk dan dipanasi, pencairan dan pemadatan berkali-kali atau sterilisasi yang terlalu lama dapat menurunkan kekuatan agar, terutama pada pH yang asam
Ø Peptone, peptone adalah produk hidrolisis protein hewani atau nabati seperti otot, liver, darah, susu, casein, lactalbumin, gelatin dan kedelai. Komposisinya tergantung pada bahan asalnya dan bagaimana cara memperolehnya.
Ø Meat extract. Meat extract mengandung basa organik terbuat dari otak, limpa, plasenta dan daging sapi.
Ø Yeast extract. Yeast extract terbuat dari ragi pengembang roti atau pembuat alcohol. Yeast extract mengandung asam amino yang lengkap & vitamin (B complex).
Ø Karbohidrat. Karbohidrat ditambahkan untuk memperkaya pembentukan asam amino dan gas dari karbohidrat. Jenis karbohidrat yang umumnya digunkan dalam amilum, glukosa, fruktosa, galaktosa, sukrosa, manitol, dll. Konsentrasi yang ditambahkan untuk analisis fermentasi adalah 0,5-1%.
Macam-Macam Media Pertumbuhan
1. Medium berdasarkan sifat fisik
Ø Medium padat yaitu media yang mengandung agar 15% sehingga setelah dingin media menjadi padat..
Ø Medium setengah padat yaitu media yang mengandung agar 0,3-0,4% sehingga menjadi sedikit kenyal, tidak padat, tidak begitu cair. Media semi solid dibuat dengan tujuan supaya pertumbuhan mikroba dapat menyebar ke seluruh media tetapi tidak mengalami percampuran sempurna jika tergoyang. Misalnya bakteri yang tumbuh pada media NfB (Nitrogen free Bromthymol Blue) semisolid akan membentuk cincin hijau kebiruan di bawah permukaan media, jika media ini cair maka cincin ini dapat dengan mudah hancur. Semisolid juga bertujuan untuk mencegah/menekan difusi oksigen, misalnya pada media Nitrate Broth, kondisi anaerob atau sedikit oksigen meningkatkan metabolisme nitrat tetapi bakteri ini juga diharuskan tumbuh merata diseluruh media.
Ø Medium cair yaitu media yang tidak mengandung agar, contohnya adalah NB (Nutrient Broth), LB (Lactose Broth).
2. Medium berdasarkan komposisi
Ø Medium sintesis yaitu media yang komposisi zat kimianya diketahui jenis dan takarannya secara pasti, misalnya Glucose Agar, Mac Conkey Agar.
Ø Medium semi sintesis yaitu media yang sebagian komposisinya diketahui secara pasti, misanya PDA (Potato Dextrose Agar) yang mengandung agar, dekstrosa dan ekstrak kentang. Untuk bahan ekstrak kentang, kita tidak dapat mengetahui secara detail tentang komposisi senyawa penyusunnya.
Ø Medium non sintesis yaitu media yang dibuat dengan komposisi yang tidak dapat diketahui secara pasti dan biasanya langsung diekstrak dari bahan dasarnya, misalnya Tomato Juice Agar, Brain Heart Infusion Agar, Pancreatic Extract.
3. Medium berdasarkan tujuan
Ø Media untuk isolasi
Media ini mengandung semua senyawa esensial untuk pertumbuhan mikroba, misalnya Nutrient Broth, Blood Agar.
Ø Media selektif/penghambat
Media yang selain mengandung nutrisi juga ditambah suatu zat tertentu sehingga media tersebut dapat menekan pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang diinginkan. Contohnya adalah Luria Bertani medium yang ditambah Amphisilin untuk merangsang E.coli resisten antibotik dan menghambat kontaminan yang peka, Ampiciline. Salt broth yang ditambah NaCl 4% untuk membunuh Streptococcus agalactiae yang toleran terhadap garam.
Ø Media diperkaya (enrichment)
Media diperkaya adalah media yang mengandung komponen dasar untuk pertumbuhan mikroba dan ditambah komponen kompleks seperti darah, serum, kuning telur. Media diperkaya juga bersifat selektif untuk mikroba tertentu. Bakteri yang ditumbuhkan dalam media ini tidak hanya membutuhkan nutrisi sederhana untuk berkembang biak, tetapi membutuhkan komponen kompleks, misalnya Blood Tellurite Agar, Bile Agar, Serum Agar, dll.
Ø Media untuk peremajaan kultur
Media umum atau spesifik yang digunakan untuk peremajaan kultur
Ø Media untuk menentukan kebutuhan nutrisi spesifik.
Media ini digunakan unutk mendiagnosis atau menganalisis metabolisme suatu mikroba. Contohnya adalah Koser’s Citrate medium, yang digunakan untuk menguji kemampuan menggunakan asam sitrat sebagai sumber karbon.
Ø Media untuk karakterisasi bakteri
Media yang digunakan untuk mengetahui kemempuan spesifik suatu mikroba. Kadang-kadang indikator ditambahkan untuk menunjukkan adanya perubahan kimia. Contohnya adalah Nitrate Broth, Lactose Broth, Arginine Agar.
Ø Media diferensial
Media ini bertujuan untuk mengidentifikasi mikroba dari campurannya berdasar karakter spesifik yang ditunjukkan pada media diferensial, misalnya TSIA (Triple Sugar Iron Agar) yang mampu memilih Enterobacteria berdasarkan bentuk, warna, ukuran koloni dan perubahan warna media di sekeliling koloni..
Pembuatan Nutrient Agar dan Nutrient Broth
Ø Pembuatan Nutrient Agar
· 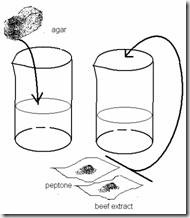 Timbang komponen medium dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:
Timbang komponen medium dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:
 Timbang komponen medium dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:
Timbang komponen medium dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:§ Beef extract 3 g
§ Peptone 5 g
§ Agar 15 g
§ Akuades s.d 1000 ml
· Akuades sebanyak 100 ml dibagi menjadi dua satu bagian untuk melarutkan Beef extract dan peptone dan sebagian lagi untuk melarutkan agar. Sebaiknya air untuk melarutkan agar lebih banyak
· 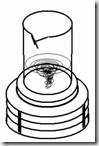
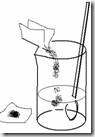 Larutkan agar pada sebagian air tersebut dengan mengaduk secara konstan dan diberi panas. Dapat menggunakan kompor gas atau hot plate stirrer (jangan sampai overheat, karena akan terbentuk busa dan memuai sehingga tumpah).
Larutkan agar pada sebagian air tersebut dengan mengaduk secara konstan dan diberi panas. Dapat menggunakan kompor gas atau hot plate stirrer (jangan sampai overheat, karena akan terbentuk busa dan memuai sehingga tumpah).

 Larutkan agar pada sebagian air tersebut dengan mengaduk secara konstan dan diberi panas. Dapat menggunakan kompor gas atau hot plate stirrer (jangan sampai overheat, karena akan terbentuk busa dan memuai sehingga tumpah).
Larutkan agar pada sebagian air tersebut dengan mengaduk secara konstan dan diberi panas. Dapat menggunakan kompor gas atau hot plate stirrer (jangan sampai overheat, karena akan terbentuk busa dan memuai sehingga tumpah). · 
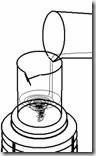 Sementara itu sebagian akuades digunakan untuk melarutkan peptone dan beef extract, cukup dengan pengadukan.
Sementara itu sebagian akuades digunakan untuk melarutkan peptone dan beef extract, cukup dengan pengadukan.

 Sementara itu sebagian akuades digunakan untuk melarutkan peptone dan beef extract, cukup dengan pengadukan.
Sementara itu sebagian akuades digunakan untuk melarutkan peptone dan beef extract, cukup dengan pengadukan. · Setelah keduanya larut, larutan dituangkan ke larutan agar dan diaduk sampai homogen. Kemudian pH media diukur dengan mencelupkan kertas pH indikator. Jika pH tidak netral maka dapat ditambahkan HCl/NaOH.
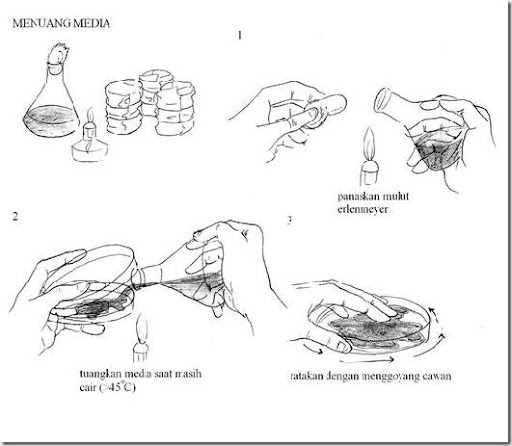
· Setelah itu media dimasukkan ke dalam labu Erlenmeyer dan disterilisasi dengan autoklaf.
· Tuang media steril ke cawan petri steril secara aseptis. Jika diinginkan media tegak atau miring pada point ke 5, media langsung dituang ke tabung kemudian disterilisasi.
Ø Pembuatan Nutrient Broth
Komposisi untuk media NB sama dengan NA tetapi tidak memakai agar sebagai pemadat. Proses pembuatannyapun lebih sederhana, tinggal melarutkan peptone dan beef extract kemudian ditampung dalam labu Erlenmeyer atau tabung reaksi dan siap disterilisasi. Proses pembuatan ini tidak memerlukan panas, peptone dan beef extract akan mudah larut sempurna pada air suhu kamar jika diaduk
Pembuatan Potato Dextrose Agar (PDA)
· Timbang komponen media dengan menggunakan timbangan analitis untuk volume yang diinginkan sesuai dengan komposisi berikut:
§ Potato/kentang 3 g
§ Peptone 5 g
§ Agar 15 g
§ Akuades s.d 1000 ml
· Rebus kentang dalam sebagian akuades tadi selama 1-3 jam sampai lunak, kemudian diambil ekstraknya dengan menyaring dan memerasnya menggunakan kertas saring lalu ditampung di Beaker glass baru.
· 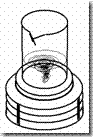 Agar dilarutkan dengan Hot Plate Stirrer dalam 50 ml akuades lalu setelah larut dapat ditambahkan dekstrosa dan dihomogenkan lagi.
Agar dilarutkan dengan Hot Plate Stirrer dalam 50 ml akuades lalu setelah larut dapat ditambahkan dekstrosa dan dihomogenkan lagi.
 Agar dilarutkan dengan Hot Plate Stirrer dalam 50 ml akuades lalu setelah larut dapat ditambahkan dekstrosa dan dihomogenkan lagi.
Agar dilarutkan dengan Hot Plate Stirrer dalam 50 ml akuades lalu setelah larut dapat ditambahkan dekstrosa dan dihomogenkan lagi.Mengetahui sterilisasi dengan autoklaf, filtrasi, tyndalisasi
mahasiswa dapat melakukan kerja aseptis
Sterilisasi :
1. Pengertian sterilisasi
2. Macam-macam sterilisasi
a. Sterilisasi secara mekanik (filtrasi)
b. Sterilisasi secara fisik
· Pemanasan
- Dengan api langsung
- Panas kering
- Uap air panas
- Uap air panas bertekanan
· Penyinaran UV
c. Sterilisasi secara kimia à dengan larutan disinfektan
3. Prosedur/Teknik aseptis
a. Mensterilkan meja kerja
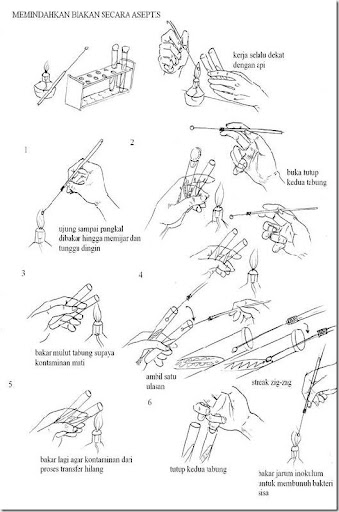
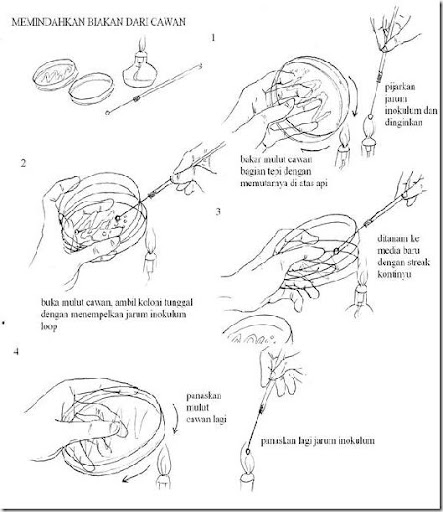
b. Memindahkan biakan (streak)
c. Menuang media
d. Pipetting
4. Prinsip cara kerja autoklaf
5. Sterilisasi dengan cara penyaringan
6. Tyndalisasi
7. Sterilisasi dengan udara panas
8. Prinsip kerja Biological Safety Cabinet
Pengertian
Sterilisasi yaitu proses atau kegiatan membebaskan suatu bahan atau benda dari semua bentuk kehidupan.
Macam-macam sterilisasi
Pada prinsipnya sterilisasi dapat dilakukan dengan 3 cara yaitu secara mekanik, fisik dan kimiawi.
1. Sterilisai secara mekanik (filtrasi) menggunakan suatu saringan yang berpori sangat kecil (0.22 mikron atau 0.45 mikron) sehingga mikroba tertahan pada saringan tersebut. Proses ini ditujukan untuk sterilisasi bahan yang peka panas, misal nya larutan enzim dan antibiotik.
2. Sterilisasi secara fisik dapat dilakukan dengan pemanasan & penyinaran.
· Pemanasan
a. Pemijaran (dengan api langsung): membakar alat pada api secara langsung, contoh alat : jarum inokulum, pinset, batang L, dll.
b. Panas kering: sterilisasi dengan oven kira-kira 60-1800C. Sterilisasi panas kering cocok untuk alat yang terbuat dari kaca misalnya erlenmeyer, tabung reaksi dll.
c. Uap air panas: konsep ini mirip dengan mengukus. Bahan yang mengandung air lebih tepat menggungakan metode ini supaya tidak terjadi dehidrasi.
d. Uap air panas bertekanan : menggunalkan autoklaf
· Penyinaran dengan UV
Sinar Ultra Violet juga dapat digunakan untuk proses sterilisasi, misalnya untuk membunuh mikroba yang menempel pada permukaan interior Safety Cabinet dengan disinari lampu UV
3. Sterilisaisi secara kimiawi biasanya menggunakan senyawa desinfektan antara lain alkohol.
Berbagai prosedur umum kerja dalam mikrobiologi yang membutuhkan teknik
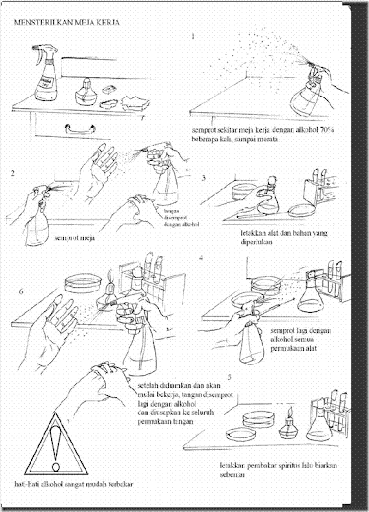
Desinfeksi meja kerja
Saran-saran kerja aseptis :
1. Sebelum membuka ruangan atau bagian steril di dalam tabung/cawan/erlenmeyer sebaiknya bagian mulut (bagian yang memungkinkan kontaminan masuk) dibakar/dilewatkan api terlebih dahulu.
2. Pinset, batang L, dll dapat disemprot dengan alkohol terlebih dahulu lalu dibakar.
3. Ujung jarum inokulum yang sudah dipijarkan harus ditunggu dingin dahulu atau dapat ditempelkan tutup cawan bagian dalam untuk mempercepat transfer panas yang terjadi.
4. Usahakan bagian alat yang diharapkan dalam kondisi steril didekatkan ke bagian api.
5. Jika kerja di Safety Cabinet tidak perlu memakai pembakar bunsen tetapi jika di luar Safety Cabinet maka semakin banyak sumber api maka semakin terjamin kondisi aseptisnya
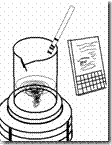
Prinsip cara kerja autoklaf
Seperti yang telah dijelaskan sebagian pada bab pengenalan alat, autoklaf adalah alat untuk memsterilkan berbagai macam alat & bahan yang menggunakan tekanan 15 psi (2 atm) dan suhu 1210C. Untuk cara kerja penggunaan autoklaf telah disampaikan di depan. Suhu dan tekanan tinggi yang diberikan kepada alat dan media yang disterilisasi memberikan kekuatan yang lebih besar untuk membunuh sel dibanding dengan udara panas. Biasanya untuk mesterilkan media digunakan suhu 1210C dan tekanan 15 lb/in2 (SI = 103,4 Kpa) selama 15 menit. Alasan digunakan suhu 1210C atau 249,8 0F adalah karena air mendidih pada suhu tersebut jika digunakan tekanan 15 psi. Untuk tekanan 0 psi pada ketinggian di permukaan laut (sea level) air mendidih pada suhu 1000C, sedangkan untuk autoklaf yang diletakkan di ketinggian sama, menggunakan tekanan 15 psi maka air akan memdididh pada suhu 1210C. Ingat kejadian ini hanya berlaku untuk sea level, jika dilaboratorium terletak pada ketinggian tertentu, maka pengaturan tekanan perlu disetting ulang. Misalnya autoklaf diletakkan pada ketinggian 2700 kaki dpl, maka tekanan dinaikkan menjadi 20 psi supaya tercapai suhu 1210C untuk mendidihkan air. Semua bentuk kehidupan akan mati jika dididihkan pada suhu 1210C dan tekanan 15 psi selama 15 menit.
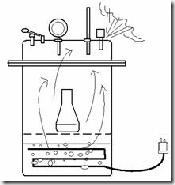 Pada saat sumber panas dinyalakan, air dalam autoklaf lama kelamaan akan mendidih dan uap air yang terbentuk mendesak udara yang mengisi autoklaf. Setelah semua udara dalam autoklaf diganti dengan uap air, katup uap/udara ditutup sehingga tekanan udara dalam autoklaf naik. Pada saat tercapai tekanan dan suhu yang sesuai., maka proses sterilisasi dimulai dan timer mulai menghitung waktu mundur. Setelah proses sterilisasi selesai, sumber panas dimatikan dan tekanan dibiarkan turun perlahan hingga mencapai 0 psi. Autoklaf tidak boleh dibuka sebelum tekanan mencapai 0 psi.
Pada saat sumber panas dinyalakan, air dalam autoklaf lama kelamaan akan mendidih dan uap air yang terbentuk mendesak udara yang mengisi autoklaf. Setelah semua udara dalam autoklaf diganti dengan uap air, katup uap/udara ditutup sehingga tekanan udara dalam autoklaf naik. Pada saat tercapai tekanan dan suhu yang sesuai., maka proses sterilisasi dimulai dan timer mulai menghitung waktu mundur. Setelah proses sterilisasi selesai, sumber panas dimatikan dan tekanan dibiarkan turun perlahan hingga mencapai 0 psi. Autoklaf tidak boleh dibuka sebelum tekanan mencapai 0 psi.Untuk mendeteksi bahwa autoklaf bekerja dengan sempurna dapat digunakan mikroba pengguji yang bersifat termofilik dan memiliki endospora yaitu Bacillus stearothermophillus, lazimnya mikroba ini tersedia secara komersial dalam bentuk spore strip. Kertas spore strip ini dimasukkan dalam autoklaf dan disterilkan. Setelah proses sterilisai lalu ditumbuhkan pada media. Jika media tetap bening maka menunjukkan autoklaf telah bekerja dengan baik.
Beberapa media atau bahan yang tidak disterilkan dengan autoklaf adalah :
- Bahan tidak tahan panas seperti serum, vitamin, antibiotik, dan enzim
- Paelarut organik, seperti fenol
- Buffer engan kandungan detergen, seperti SDS
Untuk mencegah terjadinya presipitasi, pencoklatan (media menjadi coklat) dan hancurnya substrat dapat dilakukan pencegahan sbb :
- Glukosa disterilkan terpisah dengan asam amino (peptone) atau senyawa fosfat
- Senyawa fosfat disterilkan terpisah dengan asam amino (peptone) atau senyawa garam mineral lain.
- Senyawa garam mineral disterilkan terpisah dengan agar
- Media yang memiliki pH > 7,5 jangan disterilkan dengan autoklaf
- Jangan mensterilisasi larutan agar dengan pH < 6,0
Erlenmeyer hanya boleh diisi media maksimum ¾ dari total volumenya, sisa ruang dibirkan kosong. Jika mensterilkan media 1L yang ditampung pada erlenmeyer 2L maka sterilisasi diatur dengan waktu 30 menit.
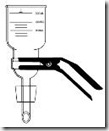
Sterilisasi dengan penyaringan (filtrasi)
Sterilisasi dengan penyaringan dilakukan untuk mensterilisasi cairan yagn mudah rusak jika terkena panas atu mudah menguap (volatile). Cairan yang disterilisasi dilewatkan ke suatu saringan (ditekan dengan gaya sentrifugasi atau pompa vakum) yang berpori dengan diameter yang cukup kecil untuk menyaring bakteri. Virus tidak akan tersaring dengan metode ini.
Sterilisasi dengan penyaringan dapat dilakukan dengan berbagai cara :
· Non-disposable filtration apparatus
- Volume 20-1000 ml
· Disposable filter cup unit
- Disedot dengan pompa vakum
- Volume 15-1000 ml
· Disposable filtration unit dengan botol penyimpan
- Volume 15-1000 ml
· Syringe filters
- Ditekan seperti jarum suntik
- Volume 1-20 ml
· Spin filters
- Ditekan dengan gaya setrifugasi
- Volume kurang dari 1 ml
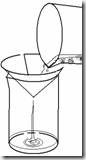
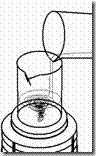
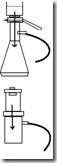
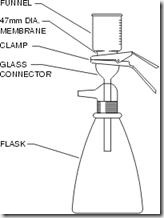
Cara kerja menggunakan Non-disposable filtration apparatus
· Sterilkan saringan (dapat menggunakan saringan Bekerfeld, Chamberland Zeitz), membran penyaring (kertas saring) dan erlenmeyer penampung.
· Pasang atau rakit alat-alat tersebut secara aseptis (sesuai gambar), lalu isi corong dengan larutan yang akan disterilkan.
· Hubungkan katup erlenmeyer dengan pompa vakum kemudian hidupkan pompa.
· setelah semua larutan melewati membran filter dan tertampung dierlenmeyer, maka larutan dapat dipindahkan kedalam gelas penampung lain yang sudah steril dan tutup dengan kapas atau aluminium foil yang steril.
Tyndalisasi
Konsep kerja metode ini merip dengan mengukus. Bahan yang mengandung air dan tidak tahan tekanan atau suhu tinggi lebih tepat disterilkan dengan metode ini. Misalnya susu yang disterilkan dengan suhu tinggi akan mengalami koagulasi dan bahan yang berpati disterilkan pada suhu bertekanan pada kondisi pH asam akan terhidrolisis.
Cara kerja :
· Bahan dimasukkan kedalam erlenmeyer atau botol dan ditutup rapat dengan sumbat atau aluminium foil.
· Erlenmeyer/botol lalu dimasukkan kedalam alat sterilisasi (alat standar menggunakan Arnold Steam Sterilizen atau dandang).
· Nyalakan sumber panas dan tunggu hingga termometer menunjukkan suhu 1000C kemudian hitung waktu mundur hingga 30 menit (uap panas yang terbentuk akan mematikan mikroba).
· Setelah selesai alat sterilisasi dimatikan dan bahan yang steril dikeluarkan.
· Setelah 24 jam, bahan tersebut di sterilkan lagi dengan cara yang sama, sedang waktu ini dimaksudkan untuk memberi kesempatan spora atau sel vegetatif yang belum mati untuk tumbuh sehingga mudah dibunuh.
Sterilisasi dengan udara panas (Dry heat sterilization)
Sterilisasi dengan metode ini biasanya digunakan untuk peralatan gelas seperti cawan petri, pipet ukur dan labu erlenmyer. Alat gelas yang disterilisasi dengan udara panas tidak akan timbul kondensasi sehingga tidak ada tetes air (embun) didalam alat gelas.
· Bungkus alat-alat gelas dengan kertas payung atau aluminium foil
· Atur pengatur suhu oven menjadi 1800C dan alat disterilkan selama 2-3 jam.
Prinsip kerja Biological Saferty Cabinet
Biological Safety Cabinet merupakan kabinet kerja yang sterilkan untuk kerja mikrobiologi. BSC memiliki suatu pengatur aliran udara yang menciptakan aliran udara kotor (dimungkinkan ada kontaminan) untuk disaring dan diresirkulasi melalui filter.
BSC juga disebut biosafety hood, dan juga dikenal dengan Laminar flow hood atau Class II vertical flow cabinet yang menyediakan alat filtrasi dan aliran udara yang bersirkulasi didalam ruang kerja. Aliran udara diatur untuk menghambat udara luar masuk dan udara di dalam keluar, untuk mencegah kontaminasi dari luar dan pencemaran bakteri dari ruang BSC. Udara yang keluar disaring melewati penyaring sehingga sel-sel yang berbahaya tidak lepas keluar ke ruangan lain.
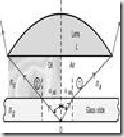
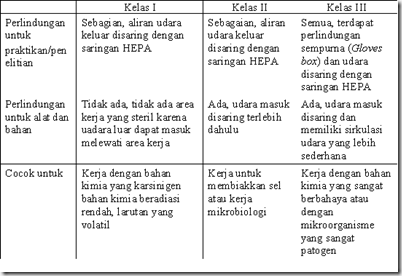
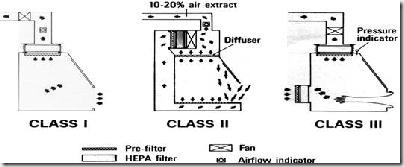
Berbagai kelas Biological Safety Cabinet.
![clip_image004[4]](http://lh5.ggpht.com/_kFz4vOoppxQ/SSPnLH_t7_I/AAAAAAAAAgc/J2k69Z2VfHw/clip_image0044_thumb5.jpg) BSC yang dimiliki Lab mikrobiologi merupakan BSC kelas II yang memiliki konfigurasi udara seperti gambar disamping ini. Udara yang berasal dari luar kabinet akan langsung terserap masuk kesaluran bawah yang bergabung dengan udara dari meja kerja yang dimungkinkan mengandung bakteri yang digunakan untuk kerja. Udara dari meja kerja disedot dari depan meja kerja. Kemudian udara kotor ini disaring oleh penyaring HEPA dan disirkulasikan keluar kabinet atau kembali lagi ke meja kerja sebagai udara bersih.
BSC yang dimiliki Lab mikrobiologi merupakan BSC kelas II yang memiliki konfigurasi udara seperti gambar disamping ini. Udara yang berasal dari luar kabinet akan langsung terserap masuk kesaluran bawah yang bergabung dengan udara dari meja kerja yang dimungkinkan mengandung bakteri yang digunakan untuk kerja. Udara dari meja kerja disedot dari depan meja kerja. Kemudian udara kotor ini disaring oleh penyaring HEPA dan disirkulasikan keluar kabinet atau kembali lagi ke meja kerja sebagai udara bersih.

























































0 comments:
Post a Comment